Descubiertos nuevos mecanismos que provocan ceguera y abren la puerta a nuevos tratamientos
Un estudio liderado por la Dra. Gemma Marfany, investigadora del Institut de Recerca Sant Joan de Deu · Institut de Biomedicina de la Universitat de Barcelona, revela cómo la falta del gen CERKL, que causa enfermedades hereditarias de la visión, es capaz de alterar la capacidad de la retina para combatir el estrés oxidativo y causar ceguera.
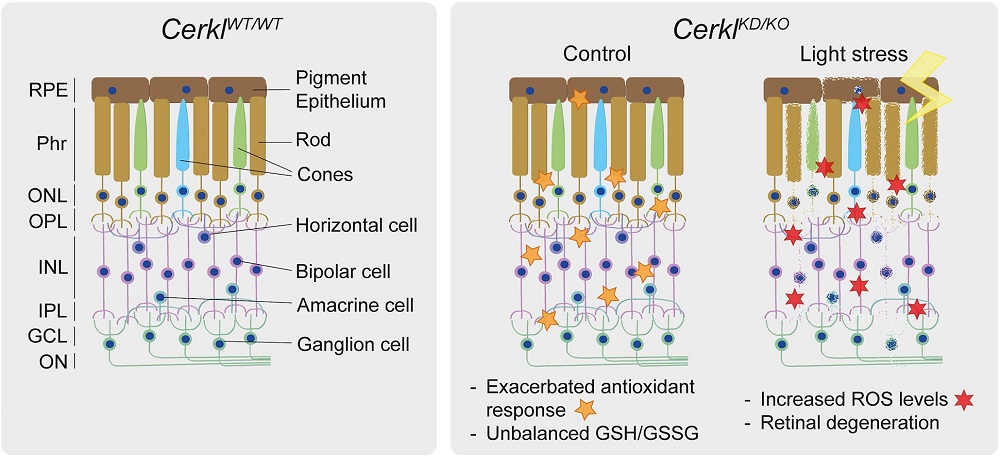
Todavía existen muchas incógnitas por resolver sobre el mecanismo de acción del gen CERKL, causante de la retinosis pigmentaria y otras enfermedades hereditarias de la visión. Ahora, un equipo liderado por la Dra. Gemma Marfany ha descrito cómo la falta del gen CERKL altera la capacidad de las células de la retina para combatir el estrés oxidativo generado por la luz y desencadena mecanismos de muerte celular que causan ceguera.
El nuevo trabajo, publicado en la revista Redox Biology, es un paso adelante para caracterizar la ceguera hereditaria e identificar mecanismos clave para abordar futuros tratamientos basados en la medicina de precisión. Y revela por primera vez que cuando falta el gen CERKL, las células de la retina están permanentemente estresadas.
“Este estado exacerbado basal hace que cuando se causa un daño oxidativo adicional -como con el estímulo continuo de la luz- las células ya no sean capaces de responder porque no pueden activar más mecanismos de respuesta antioxidante”, detalla Gemma Marfany, coordinadora del grupo de investigación Genética Molecular Humana II del IRSJD y miembro del Departamento de Genética, Microbiología y Estadística de la Universitat de Barcelona. “Por tanto, la retina está inflamada de forma permanente. Como consecuencia, las células retinales activan mecanismos de muerte celular, como la necroptosis y la ferroptosis. Aunque los experimentos se han realizado en ratón, estas alteraciones permiten explicar cómo y por qué las células fotorreceptoras mueren en los pacientes y causan la ceguera”.
¿Cómo responde la retina a la luz cuando falta el gen CERKL?
La retina es un tejido neuronal que está sometida constantemente a un estrés lumínico -por tanto, oxidativo- y las células retinales deben activar mecanismos antioxidantes para hacerle frente. El nuevo trabajo se basa en un modelo de ratón transgénico al que se le ha eliminado el gen CERKL mediante técnicas de edición génica (CRISPR). Aplicando técnicas electrofisiológicas, se comprobó cómo la retina de estos ratones sin CERKL degenera progresivamente de manera similar a los pacientes humanos. Ahora bien, ¿cómo se altera la actividad fisiológica de los fotorreceptores cuando CERKL está mutado?
“Gracias a la colaboración multidisciplinar entre equipos, hemos podido combinar distintas aproximaciones para profundizar en la patología causada por mutaciones en CERKL. Las técnicas de transcriptómica han revelado cómo responde la retina al estrés lumínico cuando no tiene la proteína CERKL. Con los análisis metabolómicos se han identificado las vías bioquímicas celulares alteradas que no permiten a la retina hacer frente al daño oxidativo generado por el exceso de luz y terminan provocando la muerte de los fotorreceptores”, indica Gemma Marfany. “Consideramos que CERKL es un gen de resiliencia en el estrés oxidativo. Todo este conocimiento complementa los estudios genéticos y abre nuevas vías a futuras aproximaciones terapéuticas”.
Descubrir la función de los genes para poder diseñar terapias
Una de cada 3000 personas en el mundo tiene algún tipo de distrofia hereditaria de retina, una de las enfermedades raras de mayor incidencia en la población. Hasta ahora, se ha identificado un total de 90 genes asociados con la retinosis pigmentaria, pero existen más de 300 genes que pueden afectar a la visión.
“Es decisivo poder realizar un buen diagnóstico genético de los pacientes e identificar el gen que causa la enfermedad. Ahora sabemos que cerca de un 3% de los pacientes con retinosis pigmentaria en España traen mutaciones en el gen CERKL”, apunta Marfany. “Buena parte de los esfuerzos enfermedades raras de la visión se centra precisamente en este diagnóstico genético de los pacientes, pero para comprender el efecto fisiológico de estas mutaciones es necesario analizar qué ocurre en las células de la retina”.
Identificar el gen causante de la enfermedad y su función fisiológica son los pilares para diseñar una terapia de precisión o personalizada. En el caso de la terapia génica, suele ser costosa -en tiempo y dinero- y sólo es accesible a un número limitado de pacientes. «Ahora bien, si conocemos mejor cuáles son las vías alteradas cuando no existe el gen CERKL, podremos pensar cómo compensar estas vías: por ejemplo, con medicamentos que puedan actuar sobre estas vías metabólicas y restaurar el correcto funcionamiento de las neuronas de la retina y devolver a un estado más homeostático. Este tipo de aproximación terapéutica es mucho más asequible, y si ralentiza el progreso de la enfermedad, podría beneficiar a muchos pacientes».
El trabajo ha sido liderado por la Dra. Gemma Marfany, investigadora del Institut de Recerca Sant Joan de Déu y catedrática de la Facultad de Biología, el Instituto de Biomedicina de la Universidad de Barcelona (IBUB) y el Centro de Investigación Biomédica en Red de Enfermedades Raras (CIBERER). También han participado en la investigación personal de la Universidad de Valencia, el Centro de Biología Molecular Severo Ochoa (CSIC-UAM) y el Instituto de Investigación Hospital 12 de Octubre de Madrid.
Noticia de referencia
Descubren nuevos mecanismos que causan ceguera y abren la puerta a nuevos tratamientos. Universitat de Barcelona.
Material audiovisual cedido por la Universitat de Barcelona.

"En el futuro, queremos generar nuevos modelos de la enfermedad con organoides de retina humana, y diseñar estrategias de terapia de precisión -terapia génica y también con medicamentos- basada en moléculas que permitan revertir los síntomas más graves de la enfermedad"